生命の時を刻むタンパク質
近藤 孝男
(名古屋大学大学院理学研究科教授・名古屋大学高等研究院長)
No.883(平成22年7月)号
一 生物時計とその三つの特徴
ちょっと意外かもしれないが、生物のひとつひとつの細胞は腕時計のような仕組みを持っている。ヒトでこの生物時計の存在を明らかにするためには、ボランティアに、外部と遮断され時間を知る手がかりがない隔離室で、二、三カ月間生活してもらう。図1に示すように、時間を知る手がかりのない条件でもヒトは周期的に睡眠・覚醒を繰り返すが、睡眠時間が一日に一時間ずつ後ろにずれていく。これは、われわれの身体の中に時計が潜んでいて、それが二五時間周期で動いていることを意味する。周期が二五時間であることは、このリズムが地球の二四時間の自転サイクルによるものではなく、生物の時計によるものであることを示している。一方、この実験中に二四時間周期の明暗のサイクルをつけると、睡眠はすぐ二四時間周期に同調する。ヒトは、本当は二五時間周期の時計を持っているのだが、毎日、一時間ずつ早起きしてそれを二四時間周期に調整しているのである。この昼夜サイクルへの同調機能も生物時計に共通する重要な特徴である。
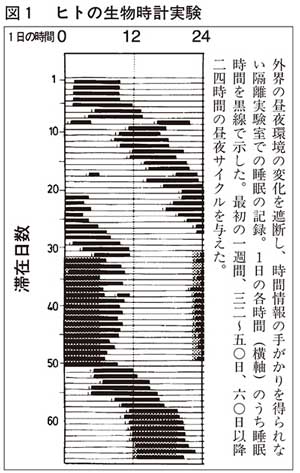
このような生物時計はほとんどすべての生物に見られるのだが、多くの生物時計を調べていくと必ず見つかる三つの性質があり、「生物時計の三条件」といわれる。一つ目は、約二四時間周期で持続すること、二つ目は、温度を変えても時計の速さはほとんど変らないことで、これを周期の「温度補償性」という。地球の自転に合わせるためには、夏と冬で時計の速さが変わると困るわけで、これを防ぐための性質と考えられている。三つ目の特徴は先ほどのヒトの場合のように、外から二四時間サイクルが与えられれば、簡単に同調できることである。生物時計は時計として不可欠なこの三つの条件を満たしてはじめて地球上で生活するために役に立つのであり、そのメリットがあるため生物時計は進化してきたわけで、これらを説明しないと生物時計の謎を解明したことにはならない。なお、生物時計の周期は概ね一日であり、正確に二四時間ではない。そこで約一日周期の時計ということで、概日時計(サーカディアンクロック)と呼ばれる。
二 時計遺伝子の発見
概日時計の謎が解明されてきたのは一九八〇年ごろから普及した遺伝子組換技術に基づく分子遺伝学的解析によるものであった。こうした解析はまず突然変異体の分離から始まる。一九七一年にショウジョウバエのper突然変異が見つかり、一九八四年にクローニングされ、その実体が明らかになった。一度手がかりが得られると、芋づる式に多くの時計遺伝子が明らかになった。またper遺伝子とよく似た遺伝子が我々哺乳類にもあることがわかり、概日時計研究はさらに我々に身近なものになっていった。一九九八年頃までに多くの重要な発見が積み重なり、時計遺伝子が時計として働く機構を説明する仮説がまとまってきた。その考えは時計遺伝子の「転写翻訳モデル」と呼ばれるもので、基本は時計遺伝子の作るタンパク質が時計遺伝子自身の働きを抑える負のフィードバック制御である。時計タンパク質が自分の発現(転写)を抑えタンパク質の合成(翻訳)が停止する。時計タンパク質が一定の速度で分解されることで、タンパク質濃度が時間経過とともに下がり、また時計遺伝子の発現が再開する。これで、二四時間の振動が発生する。実際、測ってみれば時計遺伝子のメッセンジャーRNA(mRNA)もタンパク質も少しずれた二四時間の振動を示し、時計遺伝子の発現を乱してやれば、リズムも変化する。換言すれば、分子生物学のセントラルドグマで概日時計も説明出来るということである。
三 シアノバクテリアの概日時計
私は一九九〇年ごろまで植物の概日時計を研究していたが、分子レベルの解析には限界を感じていた。そんな時にシアノバクテリアの分子生物学的解析のパイオニアであるテキサスA&M大学のスーザン・ゴールデン博士に偶然出会い、このバクテリアを利用した新しい研究を進めることが出来た。これは私にとっても大変ラッキーなことであったが、概日時計研究にとって大きな意味を持つものであった。結果として見れば、シアノバクテリアの示してくれた概日時計の謎は、おそらく他のどの生物より本質に迫るものであった。いささか因縁めくが、このバクテリア(図2)は自然がその時計の秘密を我々にささやくために準備した生物のような気がする。
最初に行ったことは概日時計に応じてシアノバクテリアを光らせることだった。まず発光細菌の生物発光遺伝子をシアノバクテリアのゲノムに組み込み、概日時計にコントロールされて発光遺伝子が動くようにいろいろ条件を試し、二四時間周期の生物発光リズムを得ることに成功した。生きた細胞の概日時計の動きを光でモニターすることで、測定が飛躍的に正確になり、バクテリアの時計であっても、温度によって周期は変わらないし、光や温度の二四時間サイクルに同調することも確認された。重要なことは、生物発光による測定を利用すれば、一万個以上のバクテリアの概日時計測定を自動化することが出来たことだ。そこで石浦正寛博士(現・名古屋大学)やカール・ジョンソン博士(現・バンダービルド大学)らとともに分子遺伝学の手法に従って突然変異体を分離し、時計遺伝子を探した。見つかったのが三つのkai遺伝子kaiA、kaiB、kaiCで、その突然変異はper遺伝子と同じように周期が長かったり短かったり、リズムが無くなった。実際、五〇以上のさまざまな突然変異はすべてkai遺伝子に変異を持っており、時が回るということでkai(回)と名づけた。
転写翻訳モデルに従ってkai遺伝子の発現を調べると、他の生物の場合と同じことが確認された。すなわち、kaiCから作られるKaiCタンパク質が自分自身の遺伝子を非常に強く抑えるのだ。実験ではKaiCタンパク質だけを細胞の中で人工的に大量につくらせる。すると、この遺伝子の発現はすぐに停まってしまう。つまり、強い負のフィードバックが起こっており、これが原因で振動が発生していることが考えられるのではないか。おまけに、一時的にKaiCタンパク質だけたくさん作らせる実験をすると、いかにもKaiCタンパク質の量を変えて、時計をずらすことも出来た。そこで、私たちはシアノバクテリアでも転写翻訳モデルが当てはまると考えた。
こうした話をすると、必ず「わかった。遺伝子発現がフィードバックを起こして振動しても不思議はないだろう。だけど、なぜ二四時間で振動するのだ。どうして一二時間じゃないんだ」と聞かれる。また、「なぜ温度を変えてもスピードは変わらないのか」と聞かれる。実は答えようがない。改めて先ほど示した三つの特徴を考えてみると、もしこの性質がなければ何の役にも立たない。温度によって変わるようでは、やっぱり不充分であろう。冷静に考えればこの時点で得られた実験結果はkaiCの転写翻訳に従って振動が発生することも有り得るという程度の意味なのであり、それを周期なども決定できる振動発生のメカニズムであると断定することはいささか早計ではないか。
四 タンパク質による時計
ではどうして二四時間になるのか。この問いに答えるには細胞の中でのKaiCタンパク質の働きを調べる必要がある。なぜならKaiCの突然変異だけ、周期が大きく変わるからだ。調べてみると、KaiCタンパク質量が多い時にタンパク質にリン酸基がつく(KaiCのリン酸化(註1))ことに気付いた。つまり、このリン酸化も一日の間でサイクルを刻んでおり、「このリン酸化は怪しい」と考えたのだが、その先はまったく手探りの状況だった。しかしこうした時は五里霧中の努力を続けていると、なぜか運のいいことがまわってくる。それを見逃さないことが重要だといわれるが、実は五里霧中の努力のおかげで真実が見えてくるのが実際のところであろう。
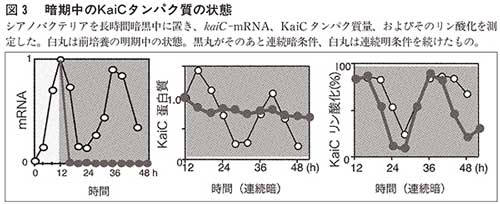
シアノバクテリアを外界の二四時間サイクルに同調させるためには、一二時間の暗期が必要で、その時「どういう仕組みで同調するか」ということが私の研究室の大学院生(当時)の冨田さんの研究テーマだった。しかし、シアノバクテリアは暗くなると転写や翻訳が止まる。そもそも転写翻訳モデルからすれば、転写や翻訳が止まるということは時計が止まるということで、それまで誰も調べなかったのだが、彼は徹夜して、暗期中のKaiCタンパク質の状態を測定してみた。予想通り遺伝子はまったく読まれなくなり、タンパク質の合成も分解も止まってしまう。しかし、驚いたことに、KaiCの量はずっと変わらないのに、KaiCのリン酸化のサイクルだけは続いており、時計が止まっていないことに彼は気づいた(図3)。さらに、このKaiCのリン酸化のサイクルは温度を変えても周期は変わらなかった。これは転写翻訳のフィードバックが振動の原因だとするモデルを根底からひっくり返し、KaiCのリン酸化のサイクルが振動の原因だということを意味する。僕たちも困ったが、他の生物の時計研究者もショックだったと思う。
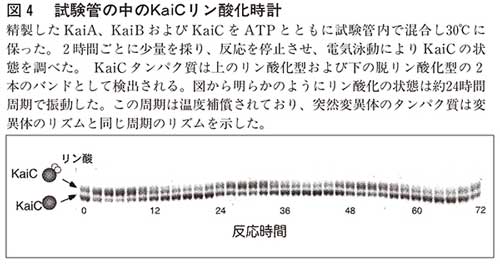
もしもこれがタンパク質だけで起こっているのなら、試験管の中でタンパク質を混ぜただけで振動が発生するのではないか。私たちは数カ月の努力の結果、試験管の中でKaiCのリン酸化振動を再構成する、つまり、概日時計を試験管の中でつくることに成功した。私たちは三つのタンパク質(KaiA、KaiB、KaiC)を精製し、エネルギー源としてのATPといっしょに混ぜ、KaiCの状態を二時間ごとに測定した。図4に示すように、リン酸化されたKaiCとそうでないKaiCは一二時間ずれたリズムを示し、交互に現れたり消えたりした。温度を変えても、この周期は変わらず、さらにKaiCの突然変異のタンパク質を精製し再構成して周期を調べてみると、もとの突然変異細胞の示す周期と同じ二一時間や二八時間という周期を示した。このデータは「試験管の中で発生しているリズムが、細胞の中で実際に時間を測定している」以外の可能性は極めて低いことを示している。
KaiCがリン酸化されたり脱リン酸化されるサイクルが実は振子として働いていて、細胞の中で起こっている遺伝子発現がのサイクルは、その時計の針に過ぎないのではないか。これまでオーケストラを指揮していたと思われていた指揮者は、実は、オーケストラに合わせて踊っていたのかもしれない。どちらの場合もほとんど同じに見えるのだから。区別するために片方を止めてみればよいのだが、その結果は冨田さんの実験が示したとおりである。生命の各プロセスは細胞の中で相互に影響しあって進んでいる。だから二つの密接に関係したプロセスの関係(原因と結果)を混同しないのは、意外に難しい。「遺伝子の発現がより重要だ」なんて思い込んでいると、ついつい「こっちが原因で、あっちが結果だ」と勝手に考えてしまう。注意が必要である。
五 ATPで時を測る
ここでは紹介しないが、タンパク質のみで構成したKaiCリン酸化サイクルは外部の温度サイクルに同調することも出来るし、KaiC分子間で時刻を同期させることも可能である。こうした驚くべき性質を目のあたりにすると、この振動が、少なくともシアノバクテリアでは、二四時間を測っている最も基本的な装置であるとの期待が高まる。では、この装置のどこに二四時間という地球の自転周期が記憶されているのか? 結論から先にいえば、KaiCによるATPの分解(註2)こそが、シアノバクテリアが時を刻む速度を決定する最も基本的な反応のようだ。そもそも主役であるKaiCは、アミノ酸配列の類似性からATP分解酵素(ATPase)に分類され、実際にKaiタンパク時計にはATPが不可欠である。ここで大切なことは、その活性がほとんどゼロといっていいほど低いことで、一つのKaiCは一日に一六個のATPを分解するだけである。これは最も活性の弱い酵素の一万分の一程度にしかならず、酵素としては壊れていると考えるべきレベルで、普通であれば測定を諦めるレベルだ。しかし、長時間根気強く測定すると二つの驚くべき性質が明らかになった。まず驚いたことは、ほとんどゼロでもその活性は大変安定で温度に左右されないことであった。さらに驚いたことに、周期の突然変異のKaiCタンパク質を使って調べると、ATPase活性と時計の速さは比例することが見つかった。つまり、ATPase活性が高いKaiCだと時計は速く、低いと遅いのである。活性が低いだけならATPase活性は「壊れかけ」の酵素として理解することも可能であるが、この二つの実験結果は、転写翻訳モデルでは説明することが絶望的であった概日時計の周期の決定機構とその温度補償性の両方をひとつのATP分解という反応が満たしていることを意味しており、この反応が概日時計の基本的なものであることを予期させる。
このATPaseの二つの性質はKaiCだけで実現されている。従って、KaiCの内部にユニークな性質を満たす仕組みが内蔵されていることになる。多くのATPaseではATP分解により発生したエネルギーはすみやかに他の分子へ移され、様々な仕事がなされるが、KaiCの場合にはこのエネルギーは分子内歪みとして蓄積され、その結果、自身の活性を強く抑えるのではないか(図5)。
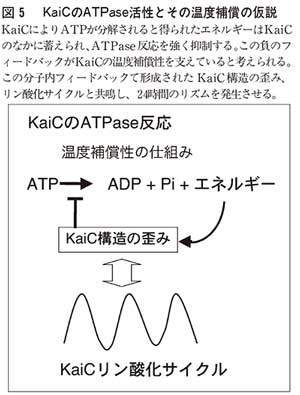
生命で見られる多くのフィードバックが複数のタンパク質のによる反応のループで成立するのに対し、これは単一のタンパク質の内部で成立する分子内フィードバックである。ATP分解のエネルギーは分子内で緊張状態を作り、その状態が解消しようとする圧力と平衡を保って、安定した状態を維持する。このためKaiCのフィードバックは通常のものに比べ、大変安定なものであることが期待できる。例えば、温度上昇によりATPase活性が強まってもブレーキも強まるので実活性は一定に保たれる。一方、KaiAとKaiBが共存すれば、この分子内緊張状態はKaiCのもう一つの機能であるリン酸化サイクルと相互作用し、緊張状態の応じた周期の安定した振動を発生させることが出来るだろう。
もう少し視野を広げれば、ATPの分解エネルギーによるタンパク質分子内フィードバックが、情報処理というこれまであまり注目されていなかった、タンパク質の機能を実現しているのかもしれない。ではKaiCはどのようにして二四時間を記憶しているのか。その答えはおそらく概日時計研究の最終解答なのだが、まったく判っていない。それが得られるためにはKaiCタンパク質のダイナミックで高精度な構造解析にもとづいたATPの分解反応の解析が不可欠である。これは大変困難な作業だが、KaiCタンパク質の原子構造の中に、これこそ時計のからくりだと、我々が感動する答えが隠されているはずである。
註1 タンパク質の中には特定のアミノ酸にリン酸基が結合したものがあり、これをタンパク質のリン酸化という。このリン酸基は特殊な酵素によって結合させたり、解離させたりできるので、生物はしばしばリン酸化をタンパク質の機能制御に用いている。
註2 ATPはアデノシン3リン酸と呼ばれる化合物で、生体内ではいろいろな生化学反応のエネルギー源として用いられる。ATPaseはこのATPを加水分解して、ADPとリン酸にする酵素。この際に放出されたエネルギーが、多くの場合、他の生体反応に利用される。
(名古屋大学大学院理学研究科教授・名古屋大学高等研究院長・名大・理博・理・昭45)